La vie dans un monde de dioxyde de carbone
Peu de produits chimiques ont fait la une des journaux si largement que tout le monde connaît leur formule, mais le dioxyde de carbone est une exception. Il est si crucial pour comprendre le changement climatique que nous reconnaissons son nom abrégé de CO2 comme une menace pour notre avenir. Pour la plupart des microbes, cependant, le CO2 ressemble plus à une fête qu’à une menace. Les microbes ont des outils à leur disposition – CO2-fixation voies – qui leur permettent d’incorporer le CO2 dans leur masse cellulaire. Ces voies sont essentielles à la vie car tous les écosystèmes de la Terre dépendent en fin de compte des cellules qui fabriquent de la matière organique à partir du CO.2. Ecrire dans Nature, Steffens et al.1 découvrir des détails clés sur une voie ingénieuse qui permet aux bactéries de se développer dans un environnement hydrothermal entouré de gaz constitués principalement de CO2.
Steffens et ses collègues ont étudié Hippea maritima les bactéries. Ces micro-organismes évitent l’oxygène, aiment les températures proches de 60 ° C et tirent leur énergie de la réaction de l’hydrogène gazeux (H2) avec du soufre pour fabriquer du sulfure d’hydrogène (H2S). Comme pour toutes les formes de vie, ils ont besoin d’une source de carbone pour se développer. Et, comme beaucoup, ils peuvent choisir cette source en fonction de ce qui est disponible dans leur environnement. Si une alimentation riche en protéines est proposée, H. maritima incorporer cela comme un élément constitutif dans leurs voies métaboliques pour la croissance.
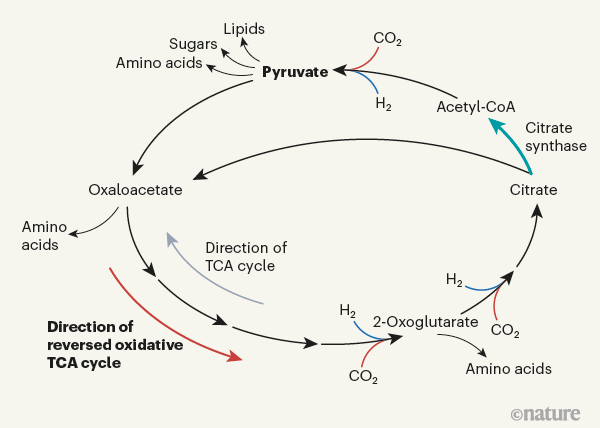
Mais si H. maritima grandir en présence de CO2 des concentrations de 40% (1000 fois plus élevées que le CO atmosphérique2 niveaux), ils font du «génie chimique», en utilisant une voie appelée cycle de l’acide tricarboxylique oxydatif inversé. Cela peut sembler compliqué, mais cela est lié à quelque chose de familier: la nutrition humaine. Une fois que les aliments que nous mangeons sont décomposés dans l’intestin, nos cellules transforment les sucres, les graisses et les protéines contenus dans les aliments en énergie et en CO2 en utilisant une voie appelée le cycle de l’acide tricarboxylique (TCA). Cela s’appelle aussi le cycle de Krebs, du nom du scientifique qui l’a découvert2. Le cycle TCA est utilisé par presque toutes les formes de vie, mais il peut fonctionner à l’envers chez certaines bactéries3: ce changement de direction, pour donner le cycle TCA oxydant inversé (Fig.1), investit de l’énergie qui convertit le CO2 en acides aminés, sucres et lipides.
Ce qui permet au cycle TCA de fonctionner en sens inverse dans des conditions de croissance spécifiques a été jusqu’à présent un mystère. Steffens et coll. montre CA H. maritimaL’astuce secrète est d’ajuster les niveaux d’une enzyme cruciale de manière inattendue, afin d’être prêt à assimiler de fortes concentrations de CO2 avant qu’ils ne soient rencontrés. Cela génère une harmonie élégante entre l’environnement du microbe et son métabolisme.
H. maritima utilise le cycle TCA oxydant inversé lorsque des niveaux élevés de CO2 sont présentes, et c’est là que la brillance technique de l’enquête de Steffens et de ses collègues devient évidente. Les auteurs ont nourri les bactéries acides aminés et CO2 étiqueté avec le 13Isotope C du carbone. Ces deux sources de nourriture ont été canalisées dans le cycle oxydatif inversé du TCA. Suivi 13L’accumulation de C dans les molécules intermédiaires de cette voie dans les cellules en croissance a permis aux auteurs de découvrir quelle source de carbone les cellules utilisaient dans quelle voie de la voie. Cela leur a également permis de déterminer combien de «tours» complets du cycle du TCA oxydant inversé se produisent lorsque le carbone est assimilé.
Cela a révélé que H. maritima utilise préférentiellement le CO2 comme source de carbone, mais seulement lorsque le CO2 est en abondance. Pour permettre au cycle TCA de fonctionner à l’envers en réponse à des niveaux élevés de CO2, les cellules abritent d’énormes quantités de l’enzyme citrate synthase. Un taux élevé de citrate synthase facilite la génération de molécules d’acétyl coenzyme A (acétyl-CoA), qui sortent du cycle oxydatif inversé du TCA en formant du pyruvate, qui est converti en lipides, sucres et acides aminés (Fig.1). Ceci à son tour, invite CO2 pour entrer dans le cycle. De cette façon, un CO environnemental élevé2 les niveaux poussent le cycle dans le sens de la conversion du CO2 à l’acétyl-CoA.
Cela entraînerait un blocage logique au stade acétyl-CoA du cycle sans les niveaux élevés de CO2. Le principal lien entre le cycle oxydatif inversé du TCA et d’autres voies métaboliques est la molécule de pyruvate, qui est faite par une réaction impliquant du CO2 et acétyl-CoA. Cette réaction, comme les deux autres réactions qui incorporent du CO2 dans ce cycle, est réversible et peut fonctionner dans les deux sens. Un CO élevé2 la concentration – généralement exprimée en pression partielle élevée par rapport à la pression totale de tous les gaz présents – pousse ces trois réactions vers l’avant. L’ensemble de la voie est ainsi poussé dans le sens de la production de pyruvate, tant qu’il n’y a pas de goulot d’étranglement au niveau de la réaction catalysée par la citrate synthase. Des quantités élevées de cette enzyme évitent ce goulot d’étranglement potentiel et maintiennent les cellules prêtes à exploiter des niveaux élevés de CO2 si l’environnement les fournit.
Écosystèmes à haute teneur en CO2 hébergent de nombreux environnements dans lesquels les microbes résidents ont des gènes qui codent pour les enzymes du cycle oxydatif inversé du TCA, comme l’a indiqué l’analyse métagénomique (séquençage du génome des communautés microbiennes)4. Cependant, la présence de gènes à elle seule ne peut pas révéler dans quelle direction les cellules utilisent une voie, car l’environnement peut dicter le flux de substrats, comme cet exemple extrêmement détaillé de H. maritima souligne.
Hippea maritima n’est pas le seul exemple connu de bactérie à métabolisme réversible. Un autre exemple est la bactérie Thermacétogénium phaeum, qui pousse dans des conditions similaires à celles qui soutiennent H. maritima (CO élevé2 et une absence d’oxygène), mais dans les réacteurs industriels de transformation de la cellulose5. Si l’environnement offre une abondance de H2 et Cie2, T. phaeum grandit en utilisant ces derniers pour fabriquer l’acétate de molécule. Cependant, si ces gaz se raréfient et que l’acétate est abondant, la principale réaction métabolique du microbe est inversée.5, et il survit à la conversion de l’acétate en H2 et Cie2. Comment il y parvient est inconnu. L’examen des gènes que les microbes utilisent dans un environnement donné peut révéler des indices importants sur les secrets de la vie dans les communautés microbiennes6. Mais pour vraiment comprendre les réactions chimiques qui soutiennent la vie microbienne, rien ne peut remplacer des études comme celles de Steffens et ses collègues, qui nous montrent, atome de carbone par atome de carbone, ce que les cellules font avec les substrats que leur environnement présente.
Les microbes individuels, tels que H. maritima, et même des écosystèmes entiers, peuvent prospérer grâce à l’énergie fournie par la réaction de H2 avec CO2. Cela offre non seulement des exemples d’écologie microbienne fascinante, mais fournit également une fenêtre sur le passé antique, en présentant des stratégies de croissance dans des conditions considérées comme similaires à celles rencontrées par les premiers microbes sur Terre.3. Ces microbes pionniers devaient pouvoir survivre avec un régime de CO2 parce que c’était la source de carbone dont la Terre primitive disposait7.
Pourtant CO2 n’est que la moitié de l’histoire. Pour convertir le CO2 en composés organiques, les microbes ont besoin d’une source d’énergie et d’électrons. Pour les premiers écosystèmes sur Terre, et pour H. maritima aujourd’hui, source d’énergie chimique et d’électrons pour le CO2 la fixation est H2. Depuis quatre milliards d’années, les microbes vivent de l’énergie fournie par les vastes quantités de H2 que la croûte terrestre génère constamment8. Compte tenu de l’effort que H. maritima investit dans la fabrication de pyruvate à partir de H2 et Cie2, il semble presque inimaginable que les toutes premières voies biochimiques aient pu commencer avant qu’il y ait des enzymes pour aider les réactions de fixation du carbone. Pourtant, étonnamment, H2 et Cie2 peut former du pyruvate pendant la nuit sans aucune implication enzymatique si des catalyseurs métalliques simples, du type de ceux que l’on trouve dans la croûte océanique, sont fournis9. Cela suggère que le métabolisme précoce sur Terre a été construit autour de la chimie naturelle entre le CO2 et H2 dans des environnements riches en minérauxdix.
Les réactions chimiques qui sous-tendent le mode de vie des H. maritima ainsi revenons à une époque où les premières cellules vivaient dans un monde de dioxyde de carbone. En enquêtant sur les cellules qui habitent encore de tels royaumes aujourd’hui, nous pouvons découvrir quelques indices sur la vie et l’époque des ancêtres microbiens les plus anciens.