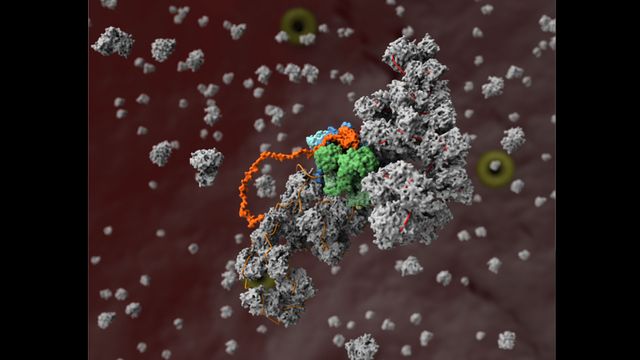
Les informations structurelles nous aident à comprendre la réplication de la grippe
Une équipe de scientifiques de l’Université d’Oxford a travaillé avec plusieurs techniques à Diamond Light Source, le synchrotron national du Royaume-Uni, pour résoudre la structure de la machinerie de réplication de la grippe et déterminer comment elle interagit avec les protéines cellulaires. Cette nouvelle recherche permet de mieux comprendre la réplication de la grippe et la façon dont le virus s’adapte à différents hôtes. Ces connaissances structurelles ont révélé de nouvelles cibles médicamenteuses potentielles pour le développement de nouveaux médicaments antiviraux pour inhiber la réplication du virus de la grippe.
L’article « Une compréhension structurelle de la réplication du génome du virus de la grippe ». Tendances en microbiologie (2022). DOI : 10.1016/j.tim.2022.09.015 décrit les résultats obtenus à l’aide de la cristallographie aux rayons X et de la diffusion des rayons X aux petits angles (SAXS) au synchrotron et à la cryo-microscopie électronique (cryo-EM) au centre de bio-imagerie électronique de Diamond (eBIC). Le document paraîtra en version imprimée dans le numéro de mars 2023 avec l’image sur sa couverture de la machinerie de réplication du virus de la grippe.
En plus de provoquer la grippe saisonnière, la grippe peut devenir pandémique lorsqu’elle passe des animaux aux humains. En examinant de plus près le cycle de réplication du virus, les chercheurs reconstituent comment la grippe détourne les cellules humaines et animales pour sa réplication. Cette recherche est cruciale pour comprendre comment une protéine cellulaire (ANP32A) explique en partie la barrière de saut d’hôte. En étudiant quelles régions de la polymérase virale interagissent avec l’ANP32A, les chercheurs ont déterminé qu’une mutation de la polymérase de la grippe aviaire pourrait lui permettre d’interagir avec l’ANP32A humain, permettant à cette souche de grippe aviaire de sauter dans des hôtes humains2.
Le virus de la grippe stocke ses gènes dans l’ARN et le virus synthétise sa propre ARN polymérase pour répliquer son génome. Cette polymérase virale a de multiples fonctions en plus de la réplication, que la recherche collaborative à travers Diamond a aidé à élucider. Ces études montrent que la polymérase régule le moment de la transcription – la première étape de la synthèse des protéines – et de la réplication, qui ne peut commencer qu’une fois que les protéines virales ont été produites. Les résultats révèlent comment la polymérase interagit avec une protéine cellulaire, ANP32A, et s’approprie celle-ci pour protéger l’ARN viral de la détection par le système immunitaire.
On pense que les virus de la grippe A actuellement en circulation sont la progéniture évolutive du virus qui a causé la pandémie mondiale de 1918-1919, responsable de 50 à 100 millions de décès dans le monde. Les virus de la grippe sont normalement limités à infecter un type d’hôte animal, comme les oiseaux, et nécessitent des adaptations spécifiques pour passer à un animal différent, comme les humains. On pense que le virus de la grippe de 1918 est passé de la sauvagine à l’homme et est considéré comme le «virus fondateur» qui a contribué aux segments du génome viral pour toutes les souches épidémiques et pandémiques ultérieures. Dans une étude publiée plus tôt cette année, le groupe a déterminé les structures de la polymérase du virus de la grippe pandémique de 1918 et identifié les sites à la surface de la polymérase qui sont sensibles à l’inhibition1. Cela peut à son tour aider à identifier et à valider des cibles pour la découverte de médicaments.
Cette recherche est cruciale pour comprendre comment ANP32A explique en partie la barrière de saut d’hôte. ANP32A diffère considérablement entre les humains et les oiseaux, forçant les virus de la grippe animale et aviaire à évoluer pour devenir moins semblables. La recherche en biologie structurale au Diamond donne un aperçu du potentiel pandémique de différentes souches de grippe. En étudiant quelles régions de la polymérase virale interagissent avec l’ANP32A, les chercheurs ont déterminé qu’une mutation de la polymérase de la grippe aviaire pourrait lui permettre d’interagir avec l’ANP32A humain, permettant à cette souche de grippe aviaire de sauter dans des hôtes humains2.
La caractérisation structurale des grands complexes protéiques est un défi, et le complexe de réplication de la grippe n’a pas fait exception. La cristallographie aux rayons X aux lignes de lumière I03 et I24 a été utilisée pour déterminer la structure de la polymérase virale avec des détails quasi atomiques, révélant que les polymérases simples s’apparient pour former des dimères. Pour compléter la structure cristalline des dimères, une technique structurelle connue sous le nom de SAXS a été réalisée en solution sur la ligne de lumière B21 pour démontrer l’importance de la formation de dimères pour la fonction des polymérases.
Les chercheurs ont proposé que les ARN polymérases simples effectuent la transcription au début de l’infection et ne passent à la réplication que lorsqu’elles se couplent ensemble sous forme de dimères, après la production de copies supplémentaires de la polymérase3.
Pour développer davantage ce travail structurel, l’équipe de recherche a effectué une cryo-EM à eBIC. Le professeur Jonathan Grimes de l’Université d’Oxford explique : «Cryo-EM nous a permis de commencer à étudier des complexes protéiques très intéressants dont il nous serait impossible de faire pousser des cristaux en laboratoire.”
Les interactions entre l’ARN et la polymérase virale ont été déterminées à l’aide de cryo-EM, révélant qu’une polymérase dans le dimère réplique le génome viral tandis que l’autre recouvre l’ARN nouvellement formé de protéines virales qui l’abritent des capteurs immunitaires. Curieusement, la grippe détourne la protéine cellulaire ANP32A pour stabiliser les dimères et pour aider à recouvrir et cacher l’ARN viral de la détection immunitaire.
« Le diamant démocratise la science», explique Grimes. « Le fait que toutes ces techniques existent en un seul endroit et soient disponibles pour la communauté scientifique est une ressource extrêmement précieuse. Ces installations de pointe de classe mondiale sont librement accessibles aux scientifiques des universités et des instituts du Royaume-Uni et de l’UE avec des questions biologiques intéressantes et importantes.”
Auteur correspondant sur le Tendances en microbiologie examen, le professeur Ervin Fodor, Université d’Oxford, conclut : «Ces études nous aident à identifier et à valider des cibles pour la découverte de médicaments. Nous espérons que les nouvelles connaissances générées sur le fonctionnement de la machinerie de transcription du virus de la grippe à l’aide des technologies de Diamond conduiront éventuellement à de nouveaux antiviraux ciblant la polymérase de la grippe..”
Référence: Zhu Z, Fodor E, Keown JR. Une compréhension structurelle de la réplication du génome du virus de la grippe. Tendances Microbiol. 2022. faire : 10.1016/j.tim.2022.09.015
Cet article a été republié à partir des documents suivants. Remarque : le matériel peut avoir été modifié pour la longueur et le contenu. Pour plus d’informations, veuillez contacter la source citée.