Rappel national volontaire de Pfizer de lots d’ACCURETIC™ (chlorhydrate de quinapril/hydrochlorothiazide), de comprimés de quinapril et d’hydrochlorothiazide et de comprimés de chlorhydrate de quinapril/hydrochlorothiazide en raison de la teneur en N-nitroso-quinapril
POUR DIFFUSION IMMÉDIATE – NEW YORK, NY, 21 mars 2022.
Pfizer rappelle volontairement les comprimés Accuretic (quinapril HCl/hydrochlorothiazide) distribués par Pfizer ainsi que deux génériques autorisés distribués par Greenstone (quinapril et hydrochlorothiazide et quinapril HCl/hydrochlorothiazide) au niveau du patient (consommateur/utilisateur) en raison de la présence d’une nitrosamine , N-nitroso-quinapril, au-dessus de la dose journalière acceptable (DJA). Pfizer rappellera six lots de comprimés Accuretic, un lot de comprimés de quinapril et d’hydrochlorothiazide et quatre lots de comprimés de quinapril HCl/hydrochlorothiazide.
Les nitrosamines sont courantes dans l’eau et les aliments, y compris les viandes salées et grillées, les produits laitiers et les légumes. Tout le monde est exposé à un certain niveau de nitrosamines. Ces impuretés peuvent augmenter le risque de cancer si les personnes y sont exposées au-dessus des niveaux acceptables pendant de longues périodes.je
Ces produits sont indiqués pour le traitement de l’hypertension. L’abaissement de la pression artérielle réduit le risque d’événements cardiovasculaires mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. ii Les produits ont un profil d’innocuité qui a été établi sur 20 ans d’autorisation de mise sur le marché et grâce à un programme clinique solide. À ce jour, Pfizer n’a pas connaissance de rapports d’événements indésirables qui ont été évalués comme étant liés à ce rappel. Pfizer estime que le profil bénéfice/risque des produits reste positif sur la base des données actuellement disponibles. Bien que l’ingestion à long terme de N-nitroso-quinapril puisse être associée à un risque potentiel accru de cancer chez l’humain, il n’y a pas de risque immédiat pour les patients qui prennent ce médicament. Les patients qui prennent actuellement les produits doivent consulter leur médecin au sujet des options de traitement alternatives.
Le NDC, le numéro de lot, la date d’expiration et les détails de configuration de ces produits sont indiqués dans les tableaux ci-dessous et des photos des produits se trouvent à la fin de ce communiqué de presse. Les lots de produits ont été distribués dans tout le pays aux grossistes et distributeurs aux États-Unis et à Porto Rico de novembre 2019 à mars 2022.
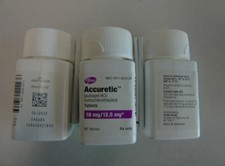
Comprimés Accuretic™ (chlorhydrate de quinapril/hydrochlorothiazide), 10/12,5 mg
Comprimés Accuretic™ (chlorhydrate de quinapril/hydrochlorothiazide), 20/12,5 mg
Comprimés Accuretic™ (chlorhydrate de quinapril/hydrochlorothiazide), 20/25mg
| CDN | Numéro de lot | Date d’expiration | Force | Configuration/Comptage |
|---|---|---|---|---|
| 0071-3112-23 | FG5379 | 08/2024 | 10/12,5 mg | 1 bouteille de 90 unités |
| 0071-0222-23 | EA6686 | 04/2022 | 10/12,5 mg | 1 bouteille de 90 unités |
| 0071-5212-23 | FG5381 | 08/2024 | 20/12,5 mg | 1 bouteille de 90 unités |
| 0071-0220-23 | EA6665 | 04/2022 | 20/12,5 mg | 1 bouteille de 90 unités |
| 0071-0220-23 | CN0640 | 04/2022 | 20/12,5 mg | 1 bouteille de 90 unités |
| 0071-0223-23 | ET6974 | 02/2023 | 20/25mg | 1 bouteille de 90 unités |
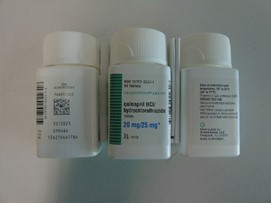
comprimés de quinapril et d’hydrochlorothiazide, 20/25mg
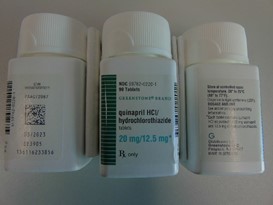
comprimés de chlorhydrate de quinapril/hydrochlorothiazide, 20/12,5 mg
comprimés de chlorhydrate de quinapril/hydrochlorothiazide, 20/25mg
| CDN | Numéro de lot | Date d’expiration | Force | Configuration/Comptage |
|---|---|---|---|---|
| 59762-5225-9 | FE3714 | 02/2023 | 20/25mg | 1 bouteille de 90 unités |
| 59762-0220-1 | DN6931 | 03/2023 | 20/12,5 mg | 1 bouteille de 90 unités |
| 59762-0220-1 | ED3904 | 03/2023 | 20/12,5 mg | 1 bouteille de 90 unités |
| 59762-0220-1 | ED3905 | 03/2023 | 20/12,5 mg | 1 bouteille de 90 unités |
| 59762-0223-1 | DP3414 | 02/2023 | 20/25mg | 1 bouteille de 90 unités |
Pfizer accorde la plus grande importance à la sécurité des patients et à la qualité des produits à chaque étape du processus de fabrication et de la chaîne d’approvisionnement. Pfizer a avisé les destinataires directs par courrier afin d’organiser le retour de tout produit rappelé.
Les grossistes et les distributeurs disposant d’un inventaire existant des lots, répertoriés dans le tableau ci-dessus, doivent arrêter l’utilisation et la distribution et mettre le produit en quarantaine immédiatement.
Si vous avez ensuite distribué le produit rappelé, veuillez en informer tous les comptes ou emplacements supplémentaires qui pourraient avoir reçu le produit rappelé de votre part. Veuillez effectuer un sous-rappel sur ces comptes et communiquer immédiatement ces informations de rappel. Veuillez demander qu’ils cessent immédiatement la distribution du produit concerné et contactez rapidement Sedgwick au 888-843-0247 (du lundi au vendredi de 8h00 à 17h00 HE) pour obtenir une carte-réponse professionnelle (BRC) afin d’initier le retour. traiter.
Les patients qui prennent ce produit doivent consulter leur fournisseur de soins de santé ou leur pharmacie pour déterminer s’ils ont le produit concerné. Les patients porteurs du produit concerné doivent contacter Sedgwick au 888-843-0247 (du lundi au vendredi de 8h00 à 17h00 HE) pour obtenir des instructions sur la façon de retourner leur produit et d’obtenir le remboursement de leur coût.
Les professionnels de la santé ayant des questions concernant ce rappel peuvent contacter Pfizer en utilisant les informations ci-dessous.
| Centre d’appels | Coordonnées | Domaine d’assistance |
|---|---|---|
| Informations médicales Pfizer
Sécurité des médicaments Pfizer |
800-438-1985, option 3 (du lundi au vendredi de 8 h 00 à 21 h HE) 800-438-1985, option 1 |
Pour des questions médicales concernant le produit
Pour signaler les événements indésirables et les réclamations concernant les produits |
Les réactions indésirables ou les problèmes de qualité rencontrés lors de l’utilisation de ce produit peuvent être signalés au programme de déclaration des événements indésirables MedWatch de la FDA, soit en ligne, par courrier ordinaire ou par fax.
- Remplir et soumettre le rapport en ligne
- Courrier ordinaire ou télécopie : Téléchargez le formulaire ou appelez le 1-800-332-1088 pour demander un formulaire de déclaration, puis remplissez et renvoyez-le à l’adresse indiquée sur le formulaire pré-adressé, ou soumettez-le par télécopieur au 1-800-FDA-0178
Ce rappel est effectué avec la connaissance de la Food and Drug Administration des États-Unis.
Les références:
je https://www.fda.gov/drugs/drug-safety-andavailability/information-about-nitrosamine-impurities-medications
ii Guillaume B, et al. Lignes directrices ESC/ESH 2018 pour la prise en charge de l’hypertension artérielle. Eur Heart J 2018;39:30213104. doi:10.1093/eurheartj/ehy339.
Annexe A : Photos du produit
Comprimés Accuretic™ (chlorhydrate de quinapril/hydrochlorothiazide)
Comprimés de quinapril et d’hydrochlorothiazide
chlorhydrate de quinapril/comprimés d’hydrochlorothiazide