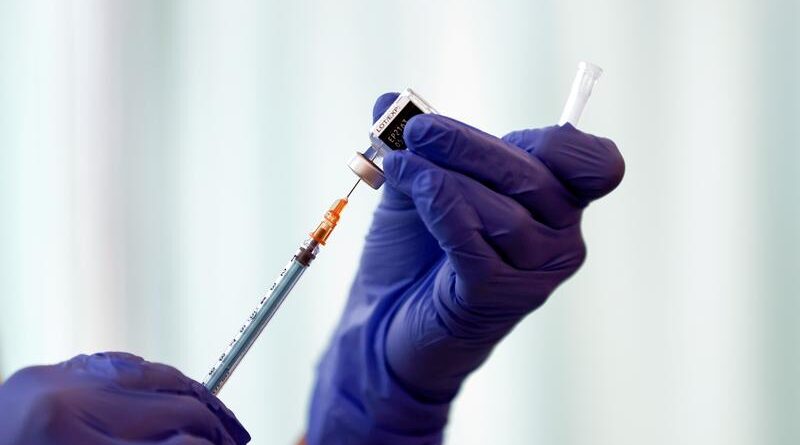
Pfizer et BioNTech commencent à tester le vaccin COVID-19 chez les femmes enceintes
CHICAGO (Reuters) – Pfizer Inc et BioNTech SE ont lancé une étude internationale avec 4000 volontaires pour évaluer la sécurité et l’efficacité de leur vaccin COVID-19 chez les femmes enceintes en bonne santé, ont annoncé jeudi les sociétés.
Les femmes enceintes courent un risque plus élevé de développer un COVID-19 sévère, et de nombreux responsables de la santé publique ont recommandé à certaines femmes exerçant des professions à haut risque de prendre des vaccins contre le coronavirus même sans preuve qu’ils sont sans danger pour elles.
Le Dr William Gruber, vice-président senior de la recherche et du développement cliniques de vaccins chez Pfizer, a déclaré dans une interview que la société pourrait obtenir des résultats d’ici le quatrième trimestre de 2021.
Gruber a déclaré que les données jusqu’à présent suggèrent que les femmes enceintes atteintes de COVID-19 ont des taux plus élevés de maladie grave. Ils ont également des taux plus élevés de complications de la grossesse, telles que les naissances prématurées, par rapport aux femmes enceintes non infectées par le coronavirus.
Ce risque accru est la raison pour laquelle les régulateurs américains et les conseillers en santé publique «sont intéressés à le faire en premier lieu – afin que les gens puissent être pleinement informés sur le profil de sécurité», a-t-il déclaré.
La semaine dernière, les National Institutes of Health des États-Unis ont appelé à une plus grande inclusion des femmes enceintes et allaitantes dans la recherche sur le vaccin COVID-19.
Les bioéthiciens, les spécialistes des vaccins et de la santé maternelle soutiennent depuis des années que les femmes enceintes devraient être incluses tôt dans les essais de vaccins contre la pandémie afin de ne pas avoir à attendre longtemps après qu’un vaccin réussisse.
Néanmoins, les femmes enceintes ont été exclues des grands essais américains utilisés pour obtenir l’autorisation d’utilisation d’urgence des vaccins COVID-19.
Les fabricants de médicaments ont déclaré qu’ils devaient d’abord s’assurer que les vaccins sont sûrs et efficaces de manière plus générale.
Aux États-Unis, les organismes de réglementation exigent des fabricants de médicaments qu’ils mènent des études d’innocuité chez les animaux en gestation avant que les vaccins ne soient testés chez les femmes enceintes pour s’assurer qu’ils ne nuisent pas au fœtus ou ne conduisent pas à une fausse couche. Les entreprises ont déclaré que ces études n’ont révélé aucun nouveau risque.
Les femmes enceintes aux États-Unis ont déjà reçu leurs premières doses, ont indiqué les entreprises.
La nouvelle étude testera des femmes enceintes âgées de 18 ans et plus aux États-Unis, au Canada, en Argentine, au Brésil, au Chili, au Mozambique, en Afrique du Sud, au Royaume-Uni et en Espagne.
Les femmes recevront le vaccin pendant les semaines 24 à 34 de la gestation, recevant deux injections à 21 jours d’intervalle – le même schéma utilisé dans l’essai clinique plus large.
Peu de temps après l’accouchement, les participants qui ont reçu un placebo dans le cadre de l’essai auront la possibilité d’obtenir le vaccin proprement dit, tout en faisant partie de l’étude, ont déclaré les entreprises.
L’essai évaluera également si les femmes enceintes vaccinées transfèrent des anticorps protecteurs à leurs bébés.
Reportage de Julie Steenhuysen à Chicago et Michael Erman à Maplewood, New Jersey; Montage par Bill Berkrot