La transition vers le nouveau système européen d’information sur les essais cliniques démarre lentement – Endpoints News
Fin janvier, l’Agence européenne des médicaments a officiellement lancé son nouveau système d’information sur les essais cliniques (CTIS), bien que la migration vers la nouvelle plateforme ne fasse que commencer et que les promoteurs aient jusqu’à fin janvier 2023 avant que toutes les demandes d’essais initiaux ne doivent être soumis via le CTIS.
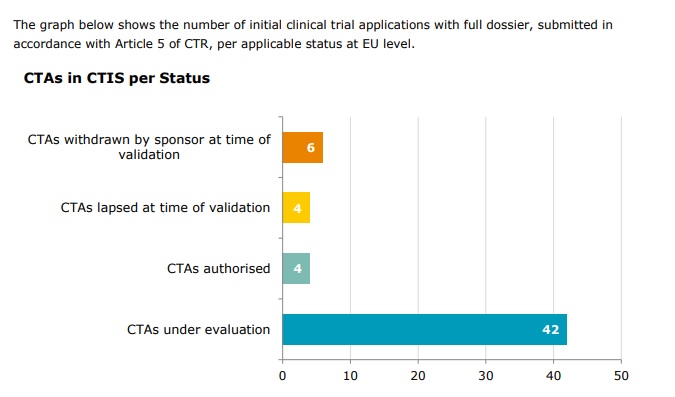
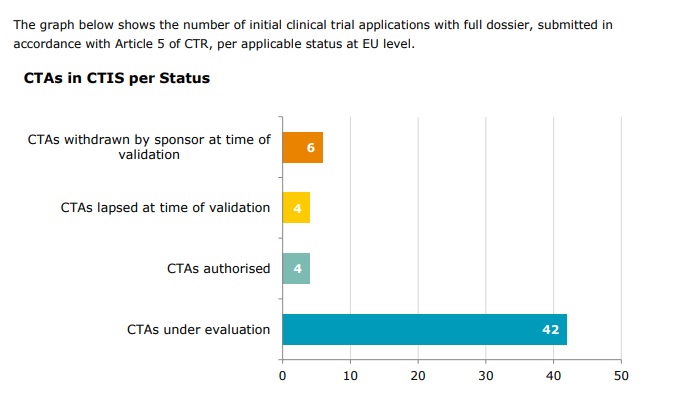
Au total, 56 demandes d’essais cliniques ont été soumises dans le CTIS au cours des 3 premiers mois depuis le lancement du système le 31 janvier, selon de nouvelles données publiées par l’EMA. À titre de comparaison, environ 4 000 nouveaux essais sont autorisés chaque année dans toute l’Europe.
En ce qui concerne le nombre d’essais pour lesquels une décision a été émise dans le CTIS par les États membres de l’UE, 4 applications non commerciales ont reçu une décision à ce jour, et 0 applications commerciales, bien que la grande majorité des applications soumises soient encore à l’étude.
« Actuellement, un essai clinique multinational a une décision (autorisée) dans le CTIS avec 14 États membres concernés », note le rapport. « Une moyenne sera fournie dans les futurs rapports lorsque plus d’un essai multinational aura une décision enregistrée. »
D’ici le 31 janvier 2025, tous les essais en cours approuvés en vertu de la directive actuelle de l’UE sur les essais seront régis par le nouveau règlement sur les essais et devront être transférés vers le nouveau CTIS.
Entre-temps, pour aider les promoteurs d’essais à remplir leurs exigences de transparence en vertu du nouveau règlement, l’EMA a déclaré qu’elle préparait des orientations sur la protection des données personnelles et des informations commercialement confidentielles dans le CTIS.
Et plus tard cet été, l’EMA a annoncé qu’elle organiserait un événement axé sur le CTIS sur les enseignements tirés au cours des six premiers mois suivant le lancement du CTIS.