La moitié de l’approvisionnement mondial en élément 99 utilisé pour révéler ses secrets chimiques | Recherche
En utilisant moins de 200 nanogrammes d’einsteinium – la moitié de l’approvisionnement mondial à cette époque – les scientifiques ont découvert pour la première fois la liaison et le comportement spectroscopique de l’élément synthétique.
Découvert dans les débris après l’explosion de la première bombe à hydrogène en 1952, l’einsteinium est un actinide hautement radioactif. Comme il ne se produit pas naturellement sur Terre, on en sait peu sur sa chimie au-delà du fait qu’il forme quelques sels d’halogénures et d’oxydes. En faire plus que des traces, cela signifie bombarder des éléments plus légers avec des neutrons pendant une période prolongée – un processus qui ne peut être effectué qu’à un seul endroit dans le monde, le réacteur isotopique à haut flux d’Oak Ridge National Laboratory dans le Tennessee, aux États-Unis.
Les derniers efforts du laboratoire n’ont produit que 400 ng d’élément 99, dont la moitié a été confiée à une équipe dirigée par Rebecca Abergel de l’Université de Californie à Berkeley, Corwin Booth du Lawrence Berkeley National Laboratory et Stosh Kozimor du Los Alamos National Laboratory. Bien qu’ils aient travaillé avec moins de 200 ng de l’élément, les chercheurs ont réussi à soumettre l’éinsteinium à des mesures d’absorption des rayons X, révélant pour la première fois sa chimie de coordination et son comportement spectroscopique.
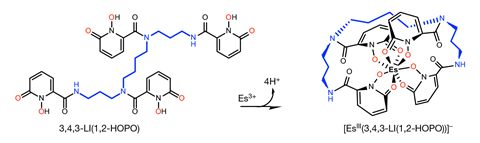
À certains égards, l’einsteinium se comporte de la même manière que ses voisins plus légers du tableau périodique, prenant un état d’oxydation +3 dans un complexe avec un ligand octadentate d’hydroxypyridinone. Cependant, la courte longueur de la liaison einsteinium-oxygène du composé a été une surprise. Les mesures par spectroscopie de luminescence ont donné un autre résultat inattendu. ‘Le chemin [einsteinium] changé lors de la complexation est dans la direction opposée en termes de changement de longueur d’onde et d’énergie que ce qui se passe avec les autres actinides », explique Abergel. L’équipe travaille maintenant à confirmer pourquoi le comportement de l’einsteinium est si différent des autres actinides.
Les règles normales ne s’appliquent plus
« Une chose dont cela parle est que nous n’avons pas une bonne idée de l’impact des effets relativistes sur la chimie de ces éléments », commente Jenifer Shafer, experte en chimie des actinides lourds à la Colorado School of Mines, États-Unis . «Les règles normales de la mécanique quantique et de la commande électronique – des choses comme la règle de Hund – semblent se dissoudre lorsque vous entrez dans cette partie du tableau périodique.
L’une des choses les plus intéressantes dans la chimie des actinides, c’est qu’il y a des éléments pour lesquels nous pouvons écrire le manuel.
Stosh Kozimor, Laboratoire national de Los Alamos
Shafer est impressionné par la capacité de l’équipe de Berkeley à réaliser les expériences en premier lieu. «Je travaille un peu avec l’einsteinium, mais je ne peux pas imaginer le défi d’essayer de coordonner l’obtention de quelques centaines de nanogrammes et d’obtenir des données chimiques importantes avec lui», dit-elle.
‘Vous ne pouvez pas vraiment voir [the material when it arrives]», se souvient Katherine Shield, chercheuse à l’UC Berkeley, qui a fait une grande partie de la chimie de laboratoire. «Il est livré dans un petit flacon, mais la seule façon de savoir que vous travaillez avec lui est d’utiliser des détecteurs de rayonnement. Outre la quantité minime avec laquelle les chercheurs ont dû travailler, la demi-vie de 275 jours de l’einsteinium signifiait qu’ils perdaient de la matière avec le temps. «Vous espérez vraiment, vraiment ne pas laisser tomber accidentellement la seule goutte pendant que vous faites la chimie», dit Shield.
Avant même de recevoir l’einsteinium, l’équipe avait soigneusement présenté les expériences qu’elle souhaitait mener et dans quel ordre, afin de minimiser les pertes de matière. «Nous avons planifié beaucoup de choses à l’avance et rien ne s’est passé comme prévu», dit Abergel en riant. Découvrant que leur échantillon contenait de grandes quantités de californium, ils ont dû abandonner les expériences de diffraction des rayons X prévues et se tourner vers la spectroscopie d’absorption des rayons X, ce qui leur a permis d’ignorer le contaminant.
Après avoir préparé le complexe d’einsteinium à Berkeley, Korey Carter, membre de l’équipe, a ensuite conduit l’échantillon précieux – et dangereux – pendant une heure jusqu’à la source lumineuse de rayonnement synchrotron de Stanford. Une fois sur place, gérer la moitié de l’approvisionnement mondial en einsteinium était «absolument terrifiant», se souvient Kozimor. « Il faut une équipe bien rodée et des nerfs stables. »
«C’est aussi un réel privilège de faire ce genre de science», déclare Abergel. Comprendre le comportement chimique de l’einsteinium pourrait aider les scientifiques à le produire et à le purifier en vue de fabriquer des éléments encore plus lourds. «Les cibles d’Einsteinium rendraient plus plausible l’identification potentielle de l’île de stabilité, ce qui est une affaire énorme pour les physiciens nucléaires», explique Shield. L’île de stabilité est un ensemble prévu d’isotopes super-lourds qui peuvent avoir des demi-vies considérablement plus longues que leurs voisins proches.
Pour l’instant, l’équipe continuera à travailler avec l’échantillon d’einsteinium restant, effectuant des expériences de microscopie électronique, de radioanalyse et de séparation. «L’une des choses les plus excitantes dans la chimie des actinides est qu’il y a des éléments pour lesquels nous pouvons écrire le manuel. C’est vraiment exploratoire », dit Kozimor.