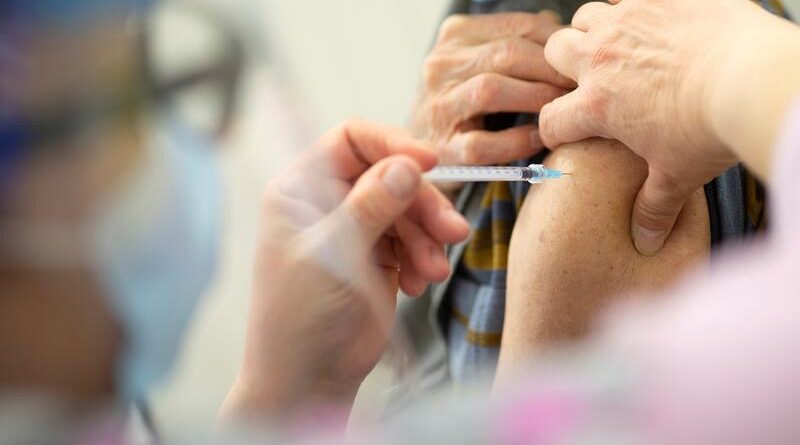
Le Canada suspend l’utilisation du vaccin AstraZeneca COVID-19 pour les moins de 55 ans et nécessite une nouvelle analyse des risques
OTTAWA / TORONTO (Reuters) – Les responsables de la santé canadiens ont déclaré lundi qu’ils cesseraient d’offrir le vaccin COVID-19 d’AstraZeneca aux personnes de moins de 55 ans et exigeraient une nouvelle analyse des avantages et des risques du vaccin en fonction de l’âge et du sexe.
Ces mouvements font suite à des rapports provenant d’Europe de caillots sanguins rares mais graves, de saignements et dans certains cas de décès après vaccination, principalement chez les jeunes femmes. Aucun cas de ce genre n’a été signalé au Canada, avec environ 307 000 doses d’AstraZeneca administrées.
«Nous suspendons l’utilisation du vaccin AstraZeneca chez les adultes de moins de 55 ans en attendant une analyse plus approfondie des risques et des avantages», a déclaré le directeur adjoint de la santé publique du Canada, Howard Njoo, lors d’un point de presse.
Njoo a noté plus tard que le Canada adoptait cette approche «prudente» parce que des vaccins de remplacement sont disponibles. Jusqu’à présent, la majeure partie de l’approvisionnement du Canada provient de Pfizer Inc et Moderna Inc.
Le Conseil consultatif national de l’immunisation (CCNI), un groupe d’experts indépendants, a déclaré que le taux auquel se produit la complication de la coagulation n’est pas encore clair. Jusqu’à présent, 40% des personnes qui l’ont développé sont décédées, mais cela pourrait diminuer car davantage de cas sont identifiés et traités tôt, a-t-il déclaré.
«D’après ce que l’on sait à l’heure actuelle, il existe une incertitude substantielle quant à l’avantage de fournir le vaccin AstraZeneca COVID-19 aux adultes de moins de 55 ans», a indiqué le conseil dans une recommandation écrite.
Les personnes âgées courent un plus grand risque d’hospitalisation et de décès dus au COVID-19, et la complication semble être plus rare dans ce groupe d’âge, a déclaré le CCNI, de sorte qu’elles peuvent se voir proposer le vaccin «avec un consentement éclairé».
Santé Canada a déclaré dans un communiqué qu’il ajouterait de nouvelles modalités et conditions aux autorisations du vaccin, y compris «une exigence que les fabricants procèdent à une évaluation détaillée des avantages et des risques du vaccin par âge et sexe dans le contexte canadien».
Santé Canada a déclaré qu’il était en pourparlers avec AstraZeneca, et une fois qu’il aura les informations demandées, il «déterminera si des mesures réglementaires supplémentaires sont nécessaires».
Le temps que l’évaluation pourrait prendre n’était pas immédiatement clair.
La pause affecte les deux versions du vaccin approuvé au Canada: une accordée à AstraZeneca Canada, et une seconde pour le Serum Institute of India (SII) – qui fabrique sa propre version du vaccin sous licence – et son partenaire canadien Verity Pharmaceuticals.
De nombreux pays européens ont brièvement arrêté d’utiliser le vaccin de la firme anglo-suédoise tout en enquêtant sur les incidents de caillots sanguins au début du mois. Le Canada a continué d’administrer des doses, faisant valoir que les avantages de la vaccination l’emportaient sur les risques potentiels.
Depuis, presque tous les pays ont repris l’utilisation du vaccin AstraZeneca. Mais la France a rompu avec les conseils du régulateur médical européen et a déclaré le 19 mars qu’elle ne devrait être donnée qu’aux personnes âgées de 55 ans ou plus. La France a déclaré que la décision était basée sur des preuves que la coagulation affectait des personnes plus jeunes.
Le Canada s’attend à recevoir 1,5 million de doses supplémentaires du vaccin AstraZeneca cette semaine en provenance des États-Unis, qui n’ont pas encore autorisé son utilisation. Le Canada a commandé plus de 20 millions de doses à AstraZeneca et SII.
Reportage de David Ljunggren et Steve Scherer à Ottawa; écrit par Allison Martell à Toronto; Édité par Paul Simao et Bill Berkrot